개발
IVI는 (보통 개발도상국의) 자격을 갖춘 백신 제조업체와 제휴해 백신을 개발한다. 파트너십은 제조업체별로 달라지나, IVI는 공정개발 및 생산규모 확대, 임상개발, 등록 및 WHO 승인 획득에 필요한 기술 이전과 기술 및 재정적 지원을 제공한다.

IVI의 파트너십은 세계 공중보건을 위해 백신의 가용성을 높인다는 공동의 목표를 기반으로 한다. 제품개발파트너십(PDP)의 핵심은 제조업체가 높은 품질의 백신을 생산해 저렴한 가격으로 충분한 양을 공공 부문에 제공하고자 하는 약속이다.
공정개발과 기술이전
파트너십 선정 과정을 통해 적격한 제조 협력기업을 탐색한다. 기술이전의 조건은 WHO가 승인한 국가 규제기관(NRA)이 있는 국가의 제조업체로서 우수한 품질의 백신을 저가로 생산하는 것이다.
IVI는 백신 항원의 수율을 극대화하고 항원의 정화도를 최적화하여 생산비용을 낮추기 위해 노력한다. 생산비용을 낮춤으로써 개발도상국에 더 저렴하게 공급할 수 있고, 백신기술 이전의 성공 가능성이 높아진다. 품질관리 평가를 실시해 공정을 관리하고 각 생산의 일관성을 확립해 최종 완제품이 규정된 품질기준에 부합할 수 있도록 한다.
| 기술이전 파트너 | 제품 개발 현황 |
|---|---|
| VaBiotech, 베트남 | 2가 경구용 콜레라 전세포 사백신 백신의 재조성 및 품질관리 분석법과 시약에 관해 기술이전 등에서 VaBiotech사와 협력함. 현재 백신은 사용허가를 받아 베트남에서 mORC-VAX로 사용 중임. |
| Shantha Biotechnics, 인도 | 2가 경구용 콜레라 전세포 사백신 인도 내 임상개발과 사용허가 및 WHO 승인을 위해 Shantha와 협력. 샨콜(Shanchol™)은 2011년 WHO 승인을 획득했으며, 현재 WHO 비축용 백신으로 사용됨. |
| 유바이오로직스, 대한민국 | 2가 경구용 콜레라 전세포 사백신 유바이오로직스와 함께 후기 임상개발 시행함. 유비콜(Euvichol®) 백신은 2016년 WHO 승인을 획득했으며, 플라스틱 포장 제형의 유비콜 플러스(Euvichol-Plus®)는 2017년 8월 승인을 획득함. |
| SK 바이오사이언스, 대한민국 | 장티푸스 단백접합 백신(Vi-DT) 필리핀에서 임상 1상 시험이 완료되어 2상 시험을 진행 중이며 임상 3상 시험을 준비 중임. BMGF와 임상 3상 시험을 위한 화학, 제조, 품질관리(CMC) 계획에 대한 합의가 이루어졌으며, 2022년까지 WHO 승인을 획득할 것으로 전망됨. |
| PT BioFarma, 인도네시아 | 장티푸스 단백접합 백신(Vi-DT) 현재 BioFarma와 함께 임상개발 중이며, 임상 1상 시험은 인도네시아에서 완료되었고, 2상은 2018년 7월 시작됨. 2022년까지 인도네시아에서 사용허가를 받을 예정이며, WHO 승인 계획 심의 중임. |
| Incepta Vaccine Ltd., 방글라데시 | 2가 경구용 콜레라 전세포 사백신장티푸스 단백접합 백신(Vi-DT) Typhoid conjugate vaccine (Vi- DT) 현재 Incepta와 함께 임상개발 중이며, 방글라데시 시장에서 콜레라 백신 사용허가 획득 준비 중임. |
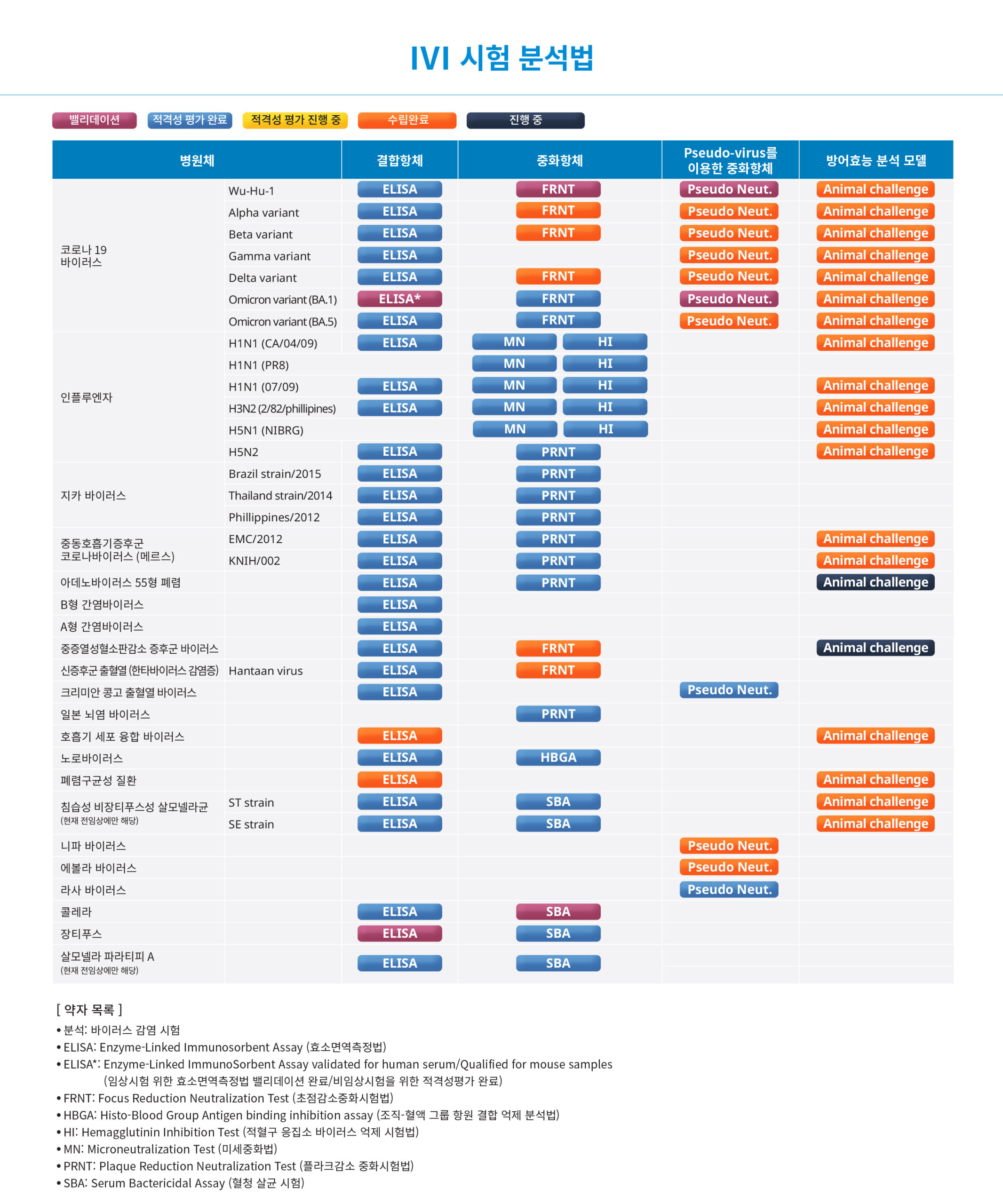
IVI 시험 분석법
IVI는 다양한 바이러스 및 박테리아 백신의 체액성 면역반응과 감염 예방 효과를 평가하기 위해 체외 및 체내 분석법(assays)을 확립했습니다. IVI에서 개발한 분석법은 전임상 및 임상 연구를 돕는 데 사용되고 있습니다. 최근에는 코로나19 백신 임상 연구에서 결합 항체(IgG) 및 중화 항체(nAb) 수준을 평가하는 데 코로나19바이러스(SARS-CoV-2)에 대한 공인된 ELISA 및 검증된 FRNT가 각각 사용되고 있습니다.
임상 개발
백신 안전성과 인체에 대한 효능을 평가하기 위해 협력기관들과 함께 임상시험을 계획하고 시행한다(임상 1상 ~ 4상 시험). 교육, 기술 및 재정적 지원을 제공하고, 국제기준과 우수 임상관행의 원칙에 부합하도록 임상시험을 조정하고 모니터링한다.
규제 관련 평가 및 승인
규제 관련 절차의 통과를 지원하고, 후보 신약 신청서에서부터 생산시설 검사에 이르기까지 다양한 준비 단계에서 지원함으로써, 새로운 백신제품이 당국의 승인을 획득할 수 있도록 규제 관련 승인절차 영역에서 해당 제조업체 또는 후원기관과 협력한다.
보다 구체적으로는, IVI는 제조업체가 백신제품의 승인을 획득할 수 있도록 지원함으로써 국가 및 국제 조달기구(예: UNICEF)가 적정 품질, 안전성, 효능 기준에 부합하는 백신과 의약품을 구매할 수 있도록 한다.
백신 안전성
IVI는 승인된 백신의 접종 후 발생하는 부작용에 대한 보고서를 보건 당국이 취합 및 분석할 수 있도록 지원함으로써 백신의 안전성에 만전을 기하고 있다. 이 과정에서 IVI는 파트너와 협력하여 예방접종 후 발생하는 부작용(AEFI)에 대한 정보를 취합 및 처리하는 백신부작용정보관리시스템(VAEIMS)이라는 소프트웨어를 개발했다.
VAEIMS는 주변 의료 센터에서 중앙 데이터베이스로 백신 안전 데이터를 효율적으로 전송하기 위해 IVI가 파트너십을 맺은 WHO 글로벌백신안전이니셔티브(GVSI)를 위해 만들어졌다.
VAEIMS는 2015년 스리랑카에서 시범 출시 후, 칠레, 이란, 라오스, 캄보디아, 몽고, 베트남에서 출시되었으며, 참가국의 긍정적인 피드백을 토대로 VAEIMS 온라인 버전, NRA 교육 프로그램, 추가 국가에서 시행 확대 등을 계획 중이다.

